SteriBase-Handbuch
| Artikel Lagerverwaltung | Bestellung | Geschäftspartner | Auftrag | Taxation / Rezeptdruck | Weitere Funktionen |
| Stoffe | Rezeptpositionen | Rechnung | Ausdruck | Produktion | Schnittstellen |
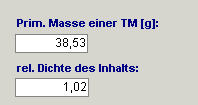
1. Bei jedem Artikel sollte eine primäre Masse und die relative Dichte
auf der Registerkarte „Volumen/Masse Info“ hinterlegt werden. Auch wenn es sich
um Trägerlösungen, Applikationsbehältnisse, Transfergeräte etc. handelt.
Grundsätzlich gilt: Bei Artikeln, deren Dichte nicht relevant ist, wird das Feld
„relative Dichte“ trotzdem mit „1“ deklariert.

2. Bei Artikeln, die aufbereitet werden müssen, muss die Dichte zusätzlich auf der Registerkarte „Aufbereitung“ für jede mögliche Aufbereitungsvariante angegeben werden.
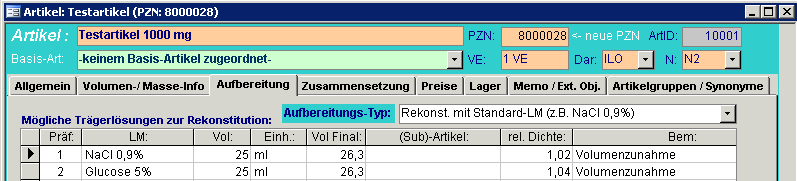
Hinterlegen Sie in jedem Fall auch den Aufbereitungs-Typ. Handelt es sich um fertige Lösungen, ist der Eintrag "Dosierfertiges Produkt" auszuwählen.
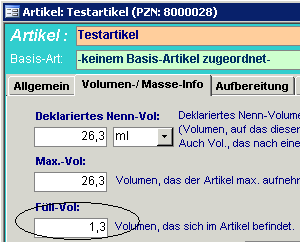
3. Bei Wirkstoff-Konzentrat-Artikel (z.B. Taxotere) und Trockensubstanzen mit
Volumenzunahme bei der Rekonstitution (z.B. Gemzar), muss das Feld „Füllvolumen“
auf der Registerkarte „Volumen/Masse Info“ mit der anfallenden Volumendifferenz
deklariert sein (war bisher auf 0,0), z.B.:
-> Taxotere 20 mg mit dem Inhalt 0,17
-> Taxotere 80 mg mit dem Inhalt 0,67
-> Gemzar 1 gr mit dem Inhalt 1,3 (Substanz+25ml Trägerlösung =26,3ml Lösung)
etc.
4. Es kann nur mit echten Lagerpositionen gearbeitet werden! Endloschargen funktionieren bei der Gravimetrie nicht.
5. Sofern bereits für einen Artikel eine echte Lagerposition existiert und
werden für diesen Artikel im Nachhinein die Stammdaten geändert, erzeugen Sie
bitte eine neue Lagerposition und setzen die alte Lagerposition auf verbraucht.
Eine Synchronisation reicht in diesem Fall evtl. nicht aus!
(Achtung: ggf. EK-Preise auch auf 0 oder anderen Preis setzen)
6. Artikel, die Sie zum Auflösen von Substanzen (NaCl, Aqua, Glucose, alle spez. Lösungsmittel/ Subartikel) und zum Auffüllen auf das Applikationsvolumen (z.B. 5-FU Pumpe) verwenden, müssen unter WEITERE und "Zuordnungen Trägerlösungen-FAM" explizit als solches zugeordnet werden. Details dazu finden Sie hier.
7. Bitte legen Sie Haltbarkeiten auf der Registerkarte Lager für die Anbrüche fest. Diese werden bei der Produktion automatisch erzeugt, als Haltbarkeitsdatum wird das vorgeschlagen und gesetzt, welches im Artikelstammsatz hinterlegt ist.
7. Dosisgenauigkeit der Wirkstoffe
In den Optionen ist als Standard-Abweichung der Dosisgenauigkeit bei der
Produktion ein Wert von 5% eingestellt. Dazu gibt es zwei Optionen für Ober- und
Untergrenze.
--> Option "Dosisgenauigkeit Obergrenze bei der Produktion" (SetID=2054)
--> Option "Dosisgenauigkeit Untergrenze bei der Produktion" (SetID=2055)
Werden in der Herstellung
nun minimale Wirkstoffmengen berücksichtigt (z.B. Vincristin Bolus 0,4mg),
können Sie die Toleranz der Dosis-Abweichung auch stoffspezifisch anpassen.
Öffnen Sie dazu das Stoffformular und auf der Registerkarte "Standards" können
Sie Ihre Werte hinterlegen, bezogen auf die Abweichung der Dosis nach unten und
nach oben.
![]()
Diese Einstellung hat Priorität. Es gelten -unabhängig davon, welche Werte in den Optionen eingestellt sind- für diesen Wirkstoff diese Toleranz-Abweichungen. Sind hier keine Werte hinterlegt, gelten die Werte in den Optionen.